研究トピックス TOPICS
- ホーム
- 研究トピックス一覧
- 化学科の研究トピックス一覧
- 研究トピックス
ラジカルと光化学反応
【化学科】大津 英揮
「ラジカル(radical)」という言葉を聞いたことがあるでしょうか。辞書(新英和・和英中辞典(研究社))で調べると、形容詞で革命的な、であったり、名詞で過激論者、と書かれているため、ちょっとびっくりするかもしれません。ラジカルという言葉は、数学など様々な分野で使われており、化学の分野では、ラジカルは不対電子を持つ常磁性化学種のことを指し、フリーラジカルとも呼ばれています。ラジカルは特殊な化学種では決してなく、非常に身近な存在です。例えば、大気中の約21%を占め、我々の生活に深く関わっている酸素(O2)は、基底状態で三重項であり、2つの不対電子を持つジラジカルです。この電子配置により、我々は呼吸してもすぐに酸素で酸化されることなく生命活動できていると言っても過言ではありません。また、一酸化窒素(NO)もラジカルであり、肺血管拡張作用があるため、医療で用いられています。有機化合物のラジカルは、およそ1世紀前にM. Gombergがトリフェニルメチルラジカルを世界で初めて報告しています1。上述したこれらのラジカルは、全て安定なものばかりですが、一般的には、ラジカルは非常に不安定で取り扱いの難しい化学種であり、ラジカルが関与する化学反応は、望ましくない副反応や連鎖反応が起こり得るため、敬遠されてきました。このことは、有機化学反応のその多くが求核置換反応や求電子付加反応、脱離反応や転位反応など極性反応から成り立っていることからも窺い知ることができます。
我々は、錯体化学や生物無機化学を基盤とした光エネルギーによるユビキタス小分子変換の化学に取り組んでいますが、光化学反応を自在に操る上で、ラジカルの制御は、避けては通れない非常に重要な課題となっています。それは、一般的な光化学反応(1光子励起)では、光化学第2法則(Stark-Einstein則)に基づき、1電子移動しか起こらないため、反応中間体として必然的にラジカルが生成するためです。これまでに、補酵素NAD(Nicotinamide Adenine Dinucleotide)のNAD+/NADH型ヒドリド(H-)授受能に倣い、犠牲試薬存在下、可視光励起されたNAD+型Ru錯体の還元的消光により生成したラジカル反応中間体同士が分子間不均化反応を経由することで、効率よく副反応なくヒドリド貯蔵したNADH型Ru錯体へと変換できることができました2。さらに、NADH型Ru錯体は、塩基存在下、二酸化炭素をギ酸へヒドリド還元できる能力があることを見出しています3, 4。近年では、レアメタルであるRuではなく、地球上に豊富に存在する金属であるZnを用い、NAD+型Ru錯体ではできなかった1級アルコールからアルデヒド(2級アルコールからケトン)の光酸化反応を達成しています(図1)5。
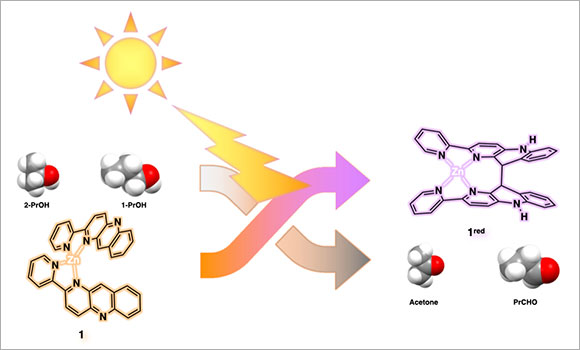
自然界では、ユビキタスな小分子(二酸化炭素、水、酸素など)の変換反応が根幹となり、共役することで太陽光エネルギーによる化学エネルギー変換・循環が行われています。我々は、光エネルギーを駆動力とした有用な物質変換とリンクしたヒドリドを貯蔵する機能、貯蔵したヒドリドによる二酸化炭素を還元する機能、を併せ持つ金属錯体光触媒の創出を目指し、研究に邁進しています。
参考文献
- M. Gomberg, J. Am. Chem. Soc. 1900, 22, 757.
- H. Ohtsu, T. Saito, K. Tsuge Frontiers in Chemistry 2019, 7, 580 and references therein.
- H. Ohtsu, K. Tanaka Angew. Chem. Int. Ed. 2012, 51, 9792.
- H. Ohtsu, K. Tsuge, K. Tanaka J. Photochem. Photobiol. A: Chem. 2015, 313, 163.
- H. Ohtsu, M. Takaoka, Y. Tezuka, K. Tsuge, K. Tanaka Chem. Commun. 2021, 57, 13574.
