研究トピックス TOPICS
- ホーム
- 研究トピックス一覧
- 生物学科の研究トピックス一覧
- 研究トピックス
予想外の結果から見出された細胞内pHリズムの存在
【生物学科】森岡 絵里
私たちヒトを含む地球上のほとんどの生物は、多種多様な生理・行動に約24時間周期のリズム(概日リズム)を持つ。この概日リズムは、脳に存在する体内時計中枢により制御されている。哺乳動物では、片側およそ8千〜1万個の神経細胞集団から成る視床下部視交叉上核が、概日リズムを統合する中枢時計として知られている。視交叉上核ニューロンの生理学的解析は盛んに行われており、切り離して培養した条件においても電気活動リズムが持続することや、細胞内Ca2+濃度リズムが存在することなど、多くの知見が得られている。これに対し、キイロショウジョウバエでは、外側ニューロン(LNs、図1)と呼ばれる片側わずか8個の神経細胞群が活動リズムを司る中枢時計とされているが、その個体サイズの小ささや培養技術の困難さから、生理学的解析はあまり行われておらず、生物種を超えて共通する体内時計中枢の生理学的な性質はまだ見つかっていない。こうした背景から、私は、これまの研究により確立した組織培養技術(Morioka et al., 2012)とバイオイメージング技法を駆使して、キイロショウジョウバエのLNsの生理学的解析に取り組んでいる。
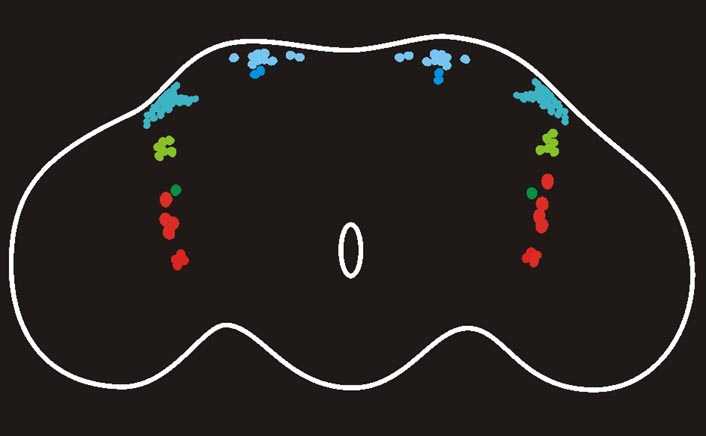
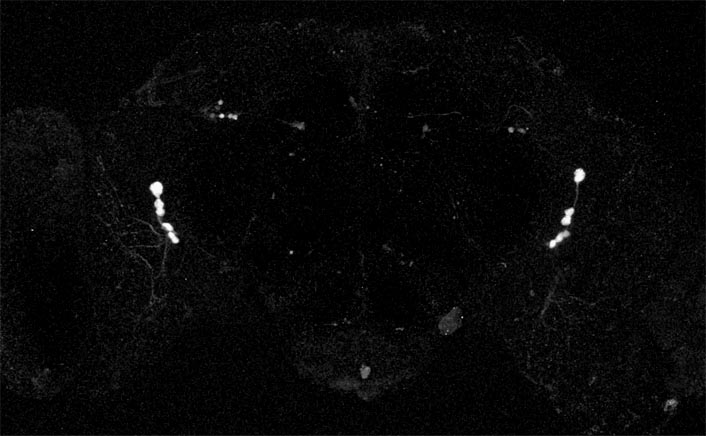
まず、蛍光Ca2+センサータンパク質であるYellow Cameleon(YC2.1)を用いて、キイロショウジョウバエのLNsに、哺乳動物と同じような細胞内Ca2+リズムが存在するかどうかを検討した。YC2.1をLNs特異的に発現させたキイロショウジョウバエの中枢神経系を組織培養し、LNsの長期Ca2+濃度測定を試みた結果、予想外に、YC2.1の2波長蛍光(480 nmと535nm)が約24時間周期でパラレルに輝度変化する様子が観察された。YC2.1は、緑色蛍光タンパク質(GFP)変異体であるCYPとYFPをCa2+結合タンパク質カルモジュリンで連結した構造を持つ、FRET(蛍光共鳴エネルギー移動)ベースの蛍光センサーである。したがって、細胞内Ca2+濃度変化が生じると、2波長蛍光(480 nmと535nm)が逆向きの輝度変化を示すはずである。実際に、ニコチン刺激により薬理的にLNs細胞内Ca2+上昇応答を引き起こすと、明瞭なFRET(480 nm蛍光は減少、535 nm蛍光は増加)が観察されたことから、このハエに発現するYC2.1がCa2+センサーとして正常に機能していることが示された。それでは、観察されたパラレルな輝度変化は、何に起因しているのだろうか。
一般的に、GFPファミリーは、酸性のpH条件では、輝度が低下することが知られており、YC2.1もその例外ではないことが報告されている。そこで、プロピオン酸を用いて細胞内pHを酸性に変化させたところ、長期YC2.1イメージングで観察された輝度変化と非常によく似た、2波長蛍光輝度のパラレルな減少が観察された。つまり、このパラレルな輝度変化は、LNsの細胞内pHが約24時間周期で振動していることが原因で生じたものと推測される。
以上の結果から、哺乳動物の体内時計ニューロンと同様の細胞内Ca2+濃度リズムが観察されないことが明らかとなった。これは、作業仮説とは一致しない、ある意味残念な結果である。しかしながら、観察された現象を正直に受け止め、原因を究明することにより、予想していなかった細胞内pHリズムの可能性を見出すことができた。現在、pHセンサータンパク質を用いたイメージング実験を行っており、LNsにおける細胞内pHリズムの存在を確認している。今後は、様々な実験手法を用いた行動学的・分子的・生理学的解析により、ショウジョウバエ体内時計機構における細胞内pH振動メカニズムの全容解明を目指したいと考えている。
【参考文献】
- Morioka E, Matsumoto A and Ikeda M. (2012) Neuronal influence on peripheral circadian oscillators in pupal Drosophila prothoracic glands. Nature Communications 3, 909.
