研究トピックス TOPICS
- ホーム
- 研究トピックス一覧
- 生物学科の研究トピックス一覧
- 研究トピックス
体内時計のコアメカニズム・遺伝子銃で解明
【生物学科】池田 真行
研究の内容
サーカディアンリズムは時計遺伝子と呼ばれる一群の遺伝子により制御されていると考えられている。時計遺伝子の転写リズムは、脳のみならず様々な末梢組織でも観察されることから、それぞれでリズムを刻む細胞を「中枢時計」と「末梢時計」と呼び分けている。皮膚からとってきた繊維芽細胞でも、条件さえ整えてやれば時計遺伝子の発現リズムを容易に観察することはできるが、いくら皮膚をいじっても寝起きのサイクルが良くなることはない。体全体のリズムは、脳に存在する中枢時計が統合的に制御しており、つまり、脳の仕組みが分からない限り、体内時計を理解したとは言えない。
では、脳に存在する体内時計とはどのようなものなのか。これまでの研究により、視神経が脳に入ったすぐの場所に、約1万個の神経細胞が集まった特殊な神経核(視床下部視交叉上核:SCN)があり、これが体内時計の中枢として機能していることが分かっている。このことは、実験動物のSCNを物理的に壊すと、動物行動のサーカディアンリズムが失われることからも伺える。専門的な研究に従事したことのない人は、ここまでわかっているのであれば、体内時計の全容解明まであと少しと思うかもしれない。しかし、体内時計の研究者の集まりの中でも、SCNを精力的に研究しようという人の数は現在あまり多くない。実は、この神経核は直径が0.5ミリほどしかなく、中に含まれる神経細胞の直径も10ミクロンに満たない。おまけに、集まっている約1万個の神経細胞は、均一な性質をもっておらず、それぞれの細胞で使われる神経伝達物質や受容体の種類が異なっている。こうした場合、研究が技術的に難しいというだけでなく、何にターゲットを絞って研究すればよいのかが分かりづらく、敷居が高くなってしまうのだ。
池田真行(いけだ まさゆき)教授らは、約10年前にSCNニューロンに特異的な生理現象として、細胞内のカルシウムイオン濃度が劇的に24時間変動していることを突き止めて以来、その分子メカニズムを探索してきた。池田正明(いけだ まさあき)教授は、1997年に時計遺伝子Bmal1を発見、命名した時計遺伝子研究の草分け的な存在である。Bmal1の名前は、脳と骨格筋を中心に発現しているArnt(Aryl hydrocarbon receptor nuclear translocator)に相同性のある因子という意味のBrain and Muscle Arnt-like 1に由来する。池田真行教授らは、数ある時計遺伝子の中でも、Bmal1は、ほぼすべてのSCN細胞に強く発現しているが、その他の脳部位ではあまり発現していないことや、この遺伝子のみの欠損(1遺伝子欠損)で、動物の行動リズムが完全に失われることに注目し、共同研究を依頼、Bmal1発現を人為的に操作するための様々な実験プローブの提供を受けてきた。
今回用いた具体的な研究手法は以下の通りである。まず、マウスの脳をスライスして培養し、SCNを顕微鏡で観察できるようにしておく。この状態で、遺伝子銃を用いて、SCN細胞に、蛍光カルシウムセンサー遺伝子と、Bmal1の発現を人為的に調節するための遺伝子を導入した(図1参照)。その後、この標本から観察される蛍光を、長期間ビデオ観察することにより、カルシウム濃度リズムに対するBmal1発現の影響を調べた。遺伝子銃を用いた場合、遺伝子導入の成否は、銃の弾に相当する金粒子が細胞に当たるのかどうかで決定される。よって、この方法を用いた場合、蛍光タンパク質を発現し、光っている細胞では、間違いなくBmal1の発現も操作されることになる。
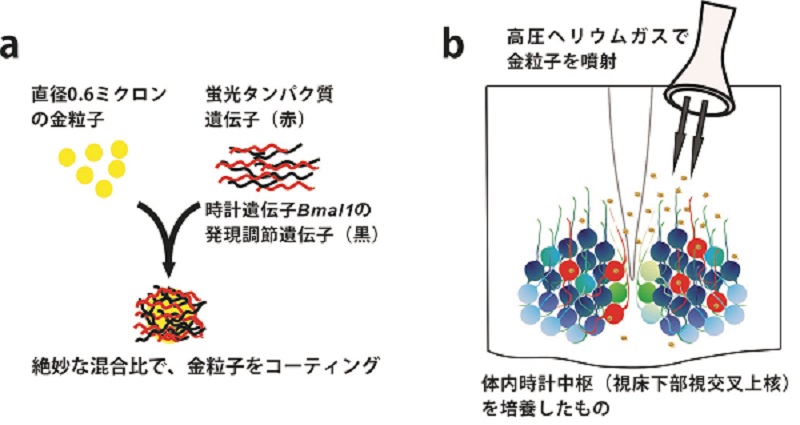
(a) 遺伝子銃の「弾」は直径0.6ミクロンの金粒子に遺伝子をコーティングしたものを用いる。今回の研究では、2種類の遺伝子でダブルコーティングして用いた。
(b) この弾を、200気圧のヘリウムガスを用いて、培養した体内時計組織に散弾させた。弾が細胞内に入った場合(赤色の細胞)、細胞は2種類の遺伝子を発現することになる。
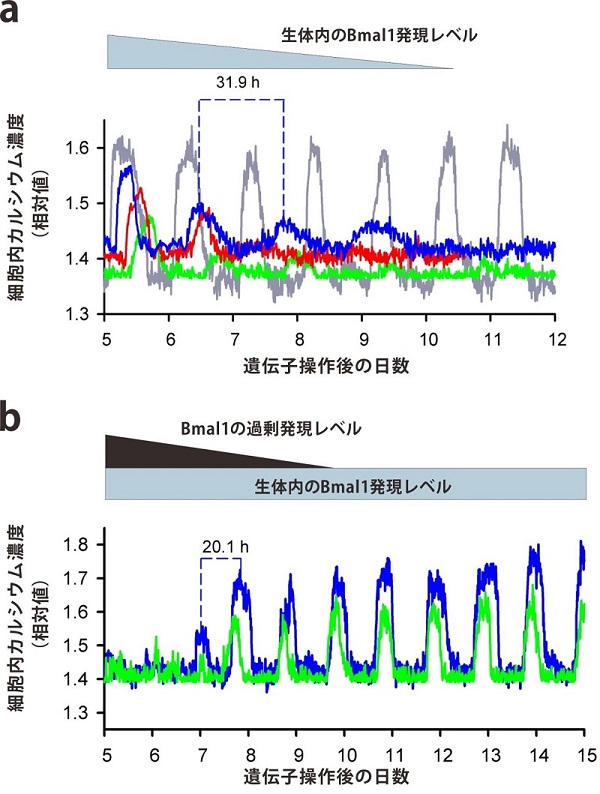
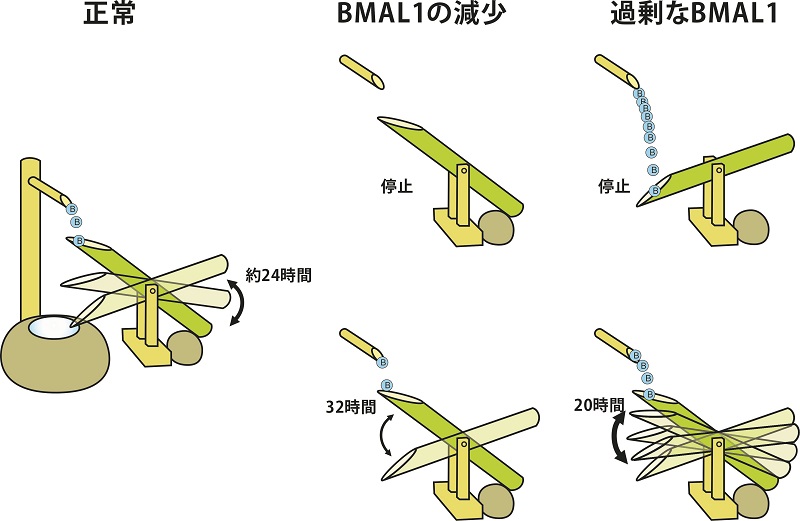
この手法を用いて、Bmal1の過剰発現やRNA干渉による発現阻害を行ったところ、蛍光シグナルから測定される約一日の細胞内カルシウム濃度のリズムが、早くなったり、遅延したりしていた(図2、3参照)。また、リズムの振幅はいずれの操作でも大きく減少していた。細胞内カルシウムイオンは、神経伝達物質の放出や、活動電位の発生、あるいは遺伝子発現に関与する細胞内シグナルメッセンジャーとして働くことが知られている。こうしたことから、今回の結果は、Bmal1が体内時計ニューロンの生理活動に決定的な役割を担っていることを証明した研究成果として注目される。
今後の予定
Bmal1発現がどのように細胞内カルシウム濃度を変動させるのかといった、細胞内情報伝達経路については残された研究課題であり、今後も研究を続けていく予定である。また、体内時計中枢の振動メカニズムのみならず、動物の昼行性・夜行性といった睡眠・覚醒時間の選択性にかかわる神経回路についても研究を展開していきたいと考えている。
【論文名】
Ikeda M & Ikeda M (2014) Bmal1 is an essential regulator for circadian cytosolic Ca2+ rhythms in suprachiasmatic nucleus neurons. The Journal of Neuroscience. 34:12029-12038.
【用語の説明】
遺伝子銃: 金粒子に付着させた遺伝子を、ヘリウムガスの圧力を用いて噴射し、細胞に取り込ませるために用いられる遺伝子導入装置。1980年代に米国で開発された。細胞壁をもつ植物細胞では、遺伝子導入のために広く良くもちいられる。また、分化した神経細胞においても効率よく遺伝子の導入をおこなうことが可能である。
時計遺伝子: サーカディアンリズムの調節を司る遺伝子群の総称。哺乳動物では、mPer1, mPer2, Clock, Bmal1, Cry1, Cry2など多数の時計遺伝子が見つかっている。これら複数の時計遺伝子産物間のタンパク質相互作用などを介して、自己の転写をフィードバック制御することにより細胞内に約24時間周期のリズムが生み出されるものと考えられているが、神経活動リズムをどのように調節しているのかについてはまだ不明な点が多い。
体内時計ニューロン: 哺乳動物の場合、視床下部視交叉上核に含まれる神経細胞のことを指す。単離培養した場合にも、約24時間周期の活動電位発火頻度を呈することが知られている。
RNA干渉: 標的遺伝子と同じ配列をもつ短い 2 本鎖の RNA を細胞内に導入すると,mRNA が分解され,遺伝子の発現が抑制(ノックダウン)される現象。本研究では、この2本鎖が切り取られやすいかたちでヘアピン型に連結したもの(shRNA)を用いて、Bmal1発現をノックダウンしている。
