研究トピックス TOPICS
- ホーム
- 研究トピックス一覧
- 生物学科の研究トピックス一覧
- 研究トピックス
摂食調節ペプチドの意外な生体機能調節
【生物学科】池田 真行
生物学研究に限らず、専門的な研究に没頭していると多様な研究の視点を失いやすい。ここでは、ある神経ペプチド(コレシストキニン)の生理機能について、研究開始当初には全く想定もしなかった機能を発見した経緯について紹介する。
コレシストキニンとは
お腹がいっぱいになると、いくら目前に御馳走が並べられても、もう食べられなくなる。「満腹中枢が刺激された」という言葉は、今日一般的によく使われるが、これはまさにそうした状況と考えられる。哺乳動物の場合、満腹中枢は後視床下部の一部の神経核(背内側核など)に存在することが知られており、その部位への「満腹情報」の伝達が満腹感を引き起こすものと考えられている。コレシストキニン(CCK)は末梢(腸管)や中枢(後視床下部など)において、満腹感を司る神経情報伝達を担うペプチドとして古くから知られている。マウスやラットにおいて、CCK-A受容体アゴニスト(CCK-8s)投与が、摂食活動を抑制することから、CCK-A受容体が満腹感を司る神経情報伝達に重要であることが示唆されている。また、Otsuka Long Evans Tokushima Fatty (OLETF) ラットは過食・肥満症状を示す動物として系統を確立されてきたが、これはコレシストキニンA(CCK-A)受容体の遺伝的欠損が関与することが示唆されている。こうしたことから、CCK-A受容体は、典型的な非インシュリン依存性糖尿病の因子であるとも考えられている。
体内時計調節とCCK
九州大学薬学部の島添隆雄准教授らのグループは、哺乳動物の体内時計中枢として知られる視床下部視交叉上核(Suprachiasmatic Nucleus: SCN)ニューロンに、CCKが多く含まれることや、摂食活動に明瞭なサーカディアンリズムが存在することなどを根拠に、体内時計とCCKの関係について兼ねてから独自の研究を展開していた。島添らによると、OLETFラットの場合、恒常暗条件における行動リズムは野生型のそれと有意な差は無いが、光パルスによりリズム位相変異を引き起こした場合には、位相調節能(位相変異量)が小さくなるという。また、同様の条件下で光パルスによるSCN内の時計遺伝子(mPer1/2)発現を解析したところ、CCK-A受容体遺伝子欠損(CCKAR-/-)マウスにおいて遺伝子発現量が有意に減少することも観察していた。体内時計の光による位相調節は、網膜からSCNへのグルタミン酸作動性の神経投射によって調節されている。よって、これらの結果は、「SCNニューロンのグルタミン酸受容や、それに伴う細胞内カルシウム流入を、CCK-A受容体が調節していること」を示唆している。われわれのグループは、SCNニューロンの細胞内カルシウムイメージング実験を専門としていることから、この作業仮説を検証すべく共同研究がスタートしたのである。
視交叉上核ニューロンそのものにはCCK-A受容体はほとんど発現しない!
受容体の所在を明らかにする研究手法はいくつか考えられる。例えば、受容体遺伝子の発現を手掛かりに所在を明らかにする手法 (in situハイブリダイゼーション法)や、受容体遺伝子プロモーターにレポーター遺伝子を連結させ、この発現の様相を観察する方法はその代表的なものである。われわれは、CCKAR-/-マウスの作成時に、ノックアウト遺伝子カセットに組み込まれたlac-Z遺伝子の発現を手掛かりに、まず、遺伝子発現の脳内分布を解析した。その結果、SCN本体にはCCK-A受容体の発現が極めて弱いことが明らかとなった。さらに、細胞内カルシウムイメージング技法で、SCNニューロンをしらみつぶしに調べても、CCK-8s応答が取れないこと(つまり生理作用を有する機能的な受容体タンパク質の発現は無いこと)が明らかになった。これらの結果は、上述した作業仮説とまったく合致しないものであった。
基本に立ち戻り、作業仮説を練り直す。
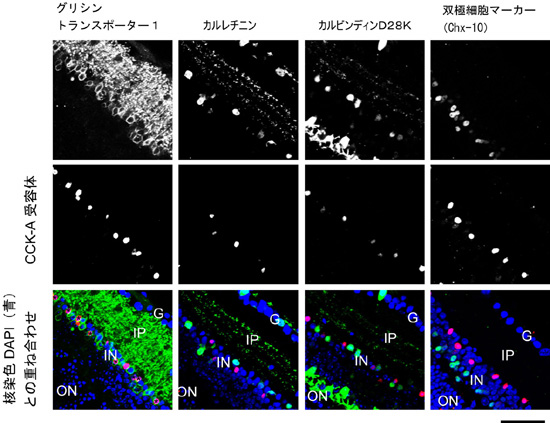
このような場合、場合によってはそれぞれの研究のクオリティーに対する疑念が生まれ、共同研究が頓挫するものだが、論文発表を急ぐ島添らに無理を言い、この謎(インコンシスタンシー)を解くための研究を進めさせていただいた。事の始まりは、体内時計の光による同調の問題である。もしや!と思い、研究のフォーカスを、その後「目」そのものへと移した。すると グリシン陽性網膜アマクリン細胞にCCK-A受容体の強い発現が認められることが明らかとなった(図1)。また、これらの細胞をカルシウムイメージング技法を用いて解析すると、大きなCCK-8s応答が観察された。つまり、CCK-A受容体による体内時計調節は、ペースメーカー本体における作用ではなく、網膜を介した間接的な作用であることが示唆された。
瓢箪から駒、CCK-A受容体による瞳孔反射調節の発見。
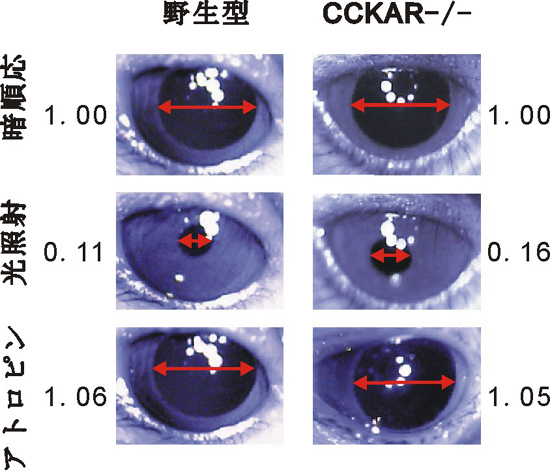
体内時計への光情報伝達は、メラノプシンを色素として含有する網膜神経節細胞の軸索投射を用いて行われる。近年、メラノプシン陽性網膜神経節細胞の軸索投射が、画像形成に関与しない光入力経路(Non-image-forming visual functions; 非画像形成視覚機能)にとって重要な役割を果たすことが示唆されている。非画像形成視覚機能には、上述した体内時計の光同調のほか、光による驚愕(きょうがく)応答や、瞳孔反射などが含まれる。そこで、グリシン陽性網膜アマクリン細胞におけるCCK-A受容体の機能が、瞳孔反射にも影響するのかを解析した。その結果、100 lux以上の光パルスによる瞳孔反射応答がCCKAR-/-マウスで有意に減弱していることが明らかとなった(図2)。
これまで、多様な動物(魚類、両生類、爬虫類、鳥類、哺乳類)の網膜にCCKが含まれることは知られていたが、個体レベルでの生理機能については全くわかっていなかった。本研究は、網膜アマクリン細胞におけるCCK-A受容体が特定の視覚機能にとって重要な役割を担っていることを示した最初の知見として注目されている。なお、研究成果は実験生物学のトップジャーナルであるThe FASEB Journal (参考文献)に掲載されている。
参考文献
- Shimazoe T, Morita M, Ogiwara S, Kojiya T, Goto J, Kamakura M, Moriya T, Shinohara K, Takiguchi S, Kono A, Miyasaka K, Funakoshi A, & Ikeda M (2008) Cholecystokinin-A receptors regulate photic input pathways to the circadian clock. FASEB J 22:1479-1490.
謝辞
- 本研究は、特定領域研究「統合脳」(神経回路)および内藤財団研究助成金によりサポートされました。